
妊娠期の化学物質曝露が孫世代の健康に
影響を及ぼすメカニズム
(筑波研究学園都市記者会、環境省記者クラブ、環境記者会、厚生労働記者会同時配布)
| 令和3年1月8日(金) 国立研究開発法人国立環境研究所 環境リスク・健康研究センター フェロー 野原恵子 主任研究員 鈴木武博 主任研究員 岡村和幸 生物・生態系環境研究センター 特別研究員 鈴木重勝 国立成育医療研究センター 周産期病態研究部 部長 秦健一郎 室長 中林一彦 |
|
環境因子の曝露を受けることによって孫世代やその子孫の健康に悪影響が現れるという現象があることが、近年明らかにされつつあります。国立環境研究所では、このような将来世代への健康影響研究を進めており、これまでに妊娠期の母マウスへの無機ヒ素曝露がその子世代のオスを介して孫世代で肝腫瘍を増加させることを見つけていました。今回、国立環境研究所と国立成育医療研究センターの研究チームは、妊娠期の無機ヒ素曝露が子世代の精子において、「動く遺伝子」といわれるレトロトランスポゾン※1の転移活性調節領域のDNAメチル化※2を低下させることを発見しました。このようにDNAが低メチル化するとレトロトランスポゾンの自律的な転移が増加し、他の遺伝子の働きを変化させる危険性が増します。またレトロトランスポゾンのDNA低メチル化は精子から次の世代に継承されて他の遺伝子機能を変化させ、発がんなどの疾患の原因となる可能性もあります。近年多くの研究から、いろいろな環境因子による多世代・継世代影響という、メカニズムが未解明である将来世代への影響が指摘されています。本研究の成果はその解明のための貴重な手がかりとなることが期待されます。 本研究の成果は、令和2年12月5日付で刊行された生命科学分野の学術誌「Epignetics & Chromatin」に掲載されました。 |
1.研究の背景
さまざまな環境因子(食物や大気から体内に取り込まれる化学物質や、栄養、ストレス、感染など)は、ヒトの健康に影響を及ぼします。特に胎児はこれらの環境因子の多くに対して感受性が高いために、妊娠期の環境因子の曝露は子に影響を及ぼしやすいと考えられています。近年、そのような子への影響が出生後すぐには顕在化せず、例えば成人期に生活習慣病になるリスクが高まるというように後発的にあらわれることや、さらにはその後の世代、すなわち孫世代や、その子孫にも影響があらわれる事象があることが、多くの研究で報告されています。
妊娠期曝露は母親と同時に胎児(子世代)が曝露を受けるだけでなく、その体内で後に孫世代となる生殖細胞も曝露を受けることから多世代曝露となります。そこで専門用語では、孫世代に現れる影響を多世代影響とよび、それ以降の子孫に現れる影響を継世代影響と呼びます(図1)。
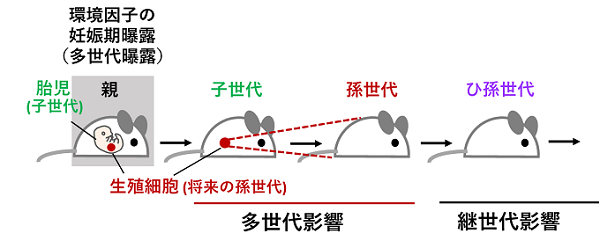
多世代影響や継世代影響をひきおこすメカニズムとして、DNAのメチル化をはじめとしたゲノムの修飾(エピゲノム※3)の関与が報告されています。DNAのメチル化は、遺伝子のオン/オフを調節したり、ゲノム上に大量に存在する「動く遺伝子」のDNAをメチル化することによってその動きを抑制するなど、生命現象の維持に重要な役割を果たしています。これらのエピゲノムは環境因子曝露によって変化を受けることが知られており、環境因子による生殖細胞のエピゲノムの変化が次世代に伝わって多世代影響や継世代影響の原因となることが予想されています。しかし実際にはどのような分子がどのように影響を伝えるかなど現象の全体像が把握できておらず、将来の世代への影響評価は今後の課題となっています。
2.研究の目的
無機ヒ素は有害性をもつ地球の微量構成元素です。世界各地の高濃度分布地域では、無機ヒ素に汚染された地下水の飲用等によって発がんをはじめとする疾患が発生し、深刻な環境問題となっています。研究チームはこれまでに、マウスの妊娠期後半に10日間無機ヒ素を含む水を自由摂取させると、その後通常の環境で飼育、交配をしても、その孫世代が成長後に肝腫瘍を高率に発症することを見つけました(9.参考文献)。さらに組み合わせ交配によって、その肝腫瘍増加はオスの子を経由して伝わっていることがわかりました(9.参考文献)。これらの結果から、子世代の精子のエピゲノム変化が孫世代に影響を伝える可能性が考えられました。そこで孫世代での肝腫瘍増加のメカニズムを探るために、妊娠期無機ヒ素曝露による子の精子のDNAメチル化変化の解析を行いました。
3.研究手法
妊娠8日目から18日までの10日間、無機ヒ素を含む水を自由摂取させたマウス(ヒ素群)と通常の水を自由摂取させたマウス(対照群)から生まれたオスの精子からDNAを調製し、Reduced Representation Bisulfite Sequencing (RRBS)法という次世代シークエンスを用いた方法でゲノム全体にわたってDNAメチル化度を測定し、対照群に対するヒ素群のDNAメチル化変化を各種アプリケーションを用いて解析しました。
4.研究結果と考察
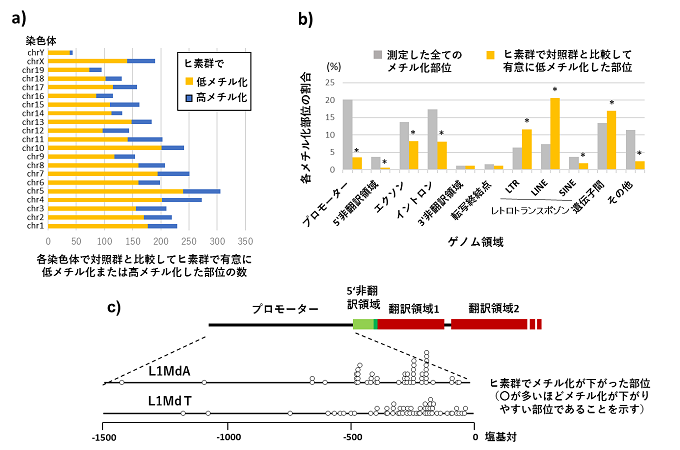
本研究によって、マウスの妊娠後期10日間の無機ヒ素曝露が生まれた子の精子のDNAメチル化を低下させることが明らかになりました(図2a)。またDNAメチル化の低下は、「動く遺伝子」であるレトロトランスポゾンの、特にLTR※1とLINE※1というグループで高頻度におこっていることがわかりました(図2b)。
ゲノム中には「動く遺伝子」といわれるレトロトランスポゾンが大量に分布しています。それらは配列的な特徴から大きく3つのグループLTR、LINEとSINEに分類されます。その大部分は進化の過程で突然変異などによって不活性化されていますが、一部は「動く」活性、すなわち転移活性を保持したものが存在します。転移活性をもつレトロトランスポゾンは自己のDNAを増幅し、ゲノム上の異なる場所に入り込むことによって他の遺伝子の働きを変化させ、その結果発がんをはじめとする疾患を起こすことがあります。通常レトロトランスポゾンの転移は、転写調節領域のDNAをメチル化するという方法で抑えられています。
そこでヒ素群で低メチル化するレトロトランスポゾンを詳しく調べると、LINEとLTRの中の転移活性をもつサブグループで低メチル化するレトロトランスポゾンが多いことがわかりました。さらにそのようなサブグループのレトロトランスポゾンで低メチル化がおこる位置を調べたところ、転移活性の調節に関わる領域(転写調節領域)に低メチル化が集中しておこることが明らかになりました(図2c)。
したがって今回の結果は、妊娠期無機ヒ素曝露が子の精子のレトトランスポゾンの転写調節領域のメチル化を低下させることによって、有害なレトロトランスポゾンの転移活性を高める可能性を示しました。それによって精子の機能が悪影響をうける可能性があります。またDNAのメチル化パターンは細胞から細胞へ、また世代間で受け継がれます。そこで子の精子ゲノムの低メチル化は受精後の次の世代に受け継がれ、孫世代でもレトロトランスポゾンの転移に影響を与え、それが孫世代での肝腫瘍の増加につながる可能性も考えられました(図3)。
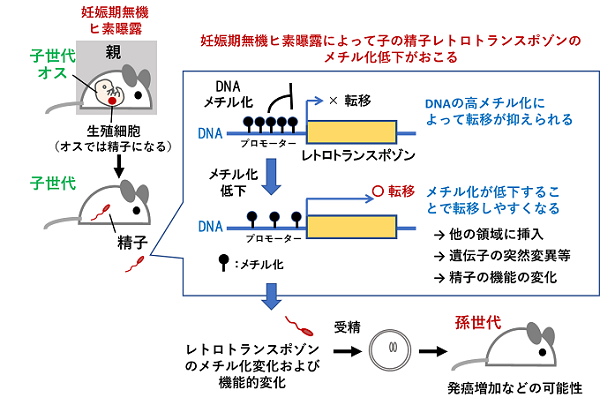
これまでの研究で、いろいろな環境因子曝露によってレトロトランスポゾンのLINEのメチル化低下が起こるが報告をされています。しかし研究チームが調べた範囲では、環境因子曝露によるレトロトランスポゾンの転写調節領域のDNAメチル化変化を調査した研究は今回が初めてであり、また精子のレトロトランスポゾンへの影響を解析した研究も多くはありません。今回の研究は、環境因子の妊娠期曝露による多世代影響のメカニズムの一つとなりうる重要な現象を明らかにしたものです。
5.今後の展望
これまでの研究で、妊娠期の無機ヒ素曝露がオスの子を介して孫世代のマウスの肝腫瘍を増加させることが観察されていました。今回、その子世代の精子でレトロトランスポゾンの転写調節領域でメチル化低下が起こっていることが見つかりました。この結果は孫世代の肝腫瘍増加のメカニズムの手がかりとなりうる貴重な知見です。また精子のレトロトランスポゾンのメチル化低下は、無機ヒ素に限らず様々な環境因子の多世代・継世代影響に関与する可能性も考えられます。しかしまだ、この精子のレトロトランスポゾンのメチル化低下が実際に孫世代にどのように影響を及ぼすか、肝腫瘍の増加に関与するのかどうかという点については明らかになっていないため、さらにメカニズム研究が必要です。
ヒトは遺伝的に、また生活環境に多様性があるために、ヒトの研究で環境因子による世代を越えた影響を検出することは極めて困難であると考えられます。そこで、遺伝的なバックグラウンドがそろった実験動物を用いた長期的な実験によってまずそのメカニズムを明らかにし、影響を検出しやすい点を見つけることが重要です。しかし動物実験の結果をヒトにあてはめるためには、考慮すべき点が多々あります。例えばマウスはヒトより無機ヒ素に対する反応性が低いために、今回の実験では環境中にあるより濃い濃度の無機ヒ素を含む水を用いています。したがって、これらの点を理解せずに動物実験の結果のみからヒトの将来の影響を考えることは適切でなく、種差を考慮し現実的な濃度でヒトでこのような現象が起こるかどうかについて、科学的データに基づいた評価が必要になります。
将来の世代の健康にかかわる問題を先のこととして見逃さず、放置せず、結果を得るまでに長い時間を要する研究を地道に進めていくことが重要であると思います。
6.注釈
※1:レトロトランスポゾン:
ゲノム上を動き回る”動く遺伝子”のうち、転写に次いで逆転写してDNAを作り、ゲノムの他の領域に挿入する遺伝子。この過程を転移という。ヒトやマウスのゲノムでは約40%の領域にレトロトランスポゾンが分布している。その配列からLTR (Long terminal repeat)とnon-LTR型に大別され、non-LTR型はさらにLINE (Long intersersed nuclear element)とSINE (Short intersersed nuclear element)に分けられる。
※2:DNAメチル化:
DNA中の主にシトシン塩基にメチル基修飾が付加される反応。DNAのメチル化は、遺伝子のオン/オフの調節や「動く遺伝子」の動きを抑制するなど、生命現象の維持に重要な役割を果たす。
※3:エピゲノム:
DNAの塩基配列からなるゲノムに対して、ゲノムに加えられた修飾の総体をエピゲノムという。修飾の主なものはDNAメチル化や、DNAが巻き付いているタンパク質であるヒストンに対するメチル化やアセチル化などがある。これらはエピジェネティック修飾ともいわれ、エピゲノムはゲノムに対するエピジェネティック修飾の全体をさす。
7.研究助成
本研究は、国立環境研究所の安全確保研究プログラム(PJ1化学物質の小児・将来世代に与える健康影響評価研究プロジェクト)ならびに科研費基盤研究(B)、挑戦的萌芽研究の研究成果です。
8.発表論文
【タイトル】
Gestational arsenic exposure induces site‑specific DNA hypomethylation in active retrotransposon subfamilies in offspring sperm in mice
【著者】
Keiko Nohara, Kazuhiko Nakabayashi, Kazuyuki Okamura, Takehiro Suzuki, Shigekatsu Suzuki and Kenichiro Hata
【雑誌】
Epigenetics & Chromatin
【DOI】
https://doi.org/10.1186/s13072-020-00375-3
【URL】
https://epigeneticsandchromatin.biomedcentral.com/articles/10.1186/s13072-020-00375-3【外部サイトに接続します】
9.参考文献
Nohara, K., Okamura, K., Suzuki, T., et al. J Appl. Toxicol. 36, 105-12, 2016.
DOI: 10.1002/jat.3149.
10.問い合わせ先
【研究に関する問い合わせ】
国立研究開発法人国立環境研究所 環境リスク・健康研究センター
フェロー 野原恵子
【報道に関する問い合わせ】
国立研究開発法人国立環境研究所 企画部広報室
kouhou0(末尾に@nies.go.jpをつけてください)
029-850-2308
国立成育医療研究センター 広報企画室
近藤・村上 koho(末尾に@ncchd.go.jpをつけてください)
03-3416-0181





